細胞内トランス-スプライシング
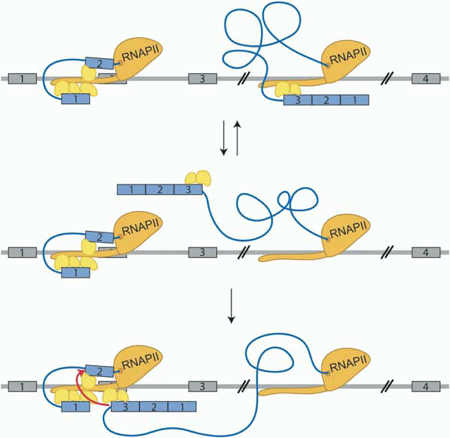
スプライシングは転写直後のmRNA前駆体から介在配列であるイントロンを除去し成熟mRNAを生成する反応です。スプライシングの多くは1つのmRNA前駆体中のスプライス部位を用いた反応(シス-スプライシング)ですが、別々に生合成されたmRNA前駆体上のスプライス部位を用いたスプライシング(トランス-スプライシング)も起こります。トランス-スプライシングは、最初、in vitroアッセイ系を用いて示されましたが、その後、さまざまな生物種の細胞内でも起きていることが確認されており、高等生物においてはショウジョウバエとほ乳類の細胞中で起っていることが確認されています。 ほ乳類の細胞内におけるトランス-スプライシングは1998年に最初に発見されましたが、ほぼ同時期に、私たちも転写因子Sp1 のmRNA前駆体間でトランス-スプライシングが起きていることを発見しました(J. Biol. Chem. 275, 38067-38072, 2000; Biochem. Biophys. Res. Commun. 298, 156-262, 2002)。すなわち、23 kbと大きなイントロンである第3イントロンの5'スプライス部位と第2イントロンの3'スプライス部位との間でスプライシングが起こることにより、エクソンが重複した構造を持つSp1 mRNAが生成していることを見出しました。このトランス-スプライシングの分子メカニズムの解析から、塩基配列ではなく、イントロンの大きさがトランス-スプライシングには重要であることを明らかにしました(Mol. Cell 18, 245-251, 2005)。転写途上のmRNA前駆体中の5'スプライス部位はRNAポリメレースIIのCTDと相互作用しており、下流の3'スプライス部位が合成されるとスプライシング反応が進行します。大きなイントロンの存在によって二つの反応(転写とスプライシング)の共役がうまくいかなくなるとトランス-スプライシングが起こると考えられました。すなわち、イントロンが大きいほど、5'スプライス部位が合成されてから3'スプライス部位が合成されるまでに長い時間が必要となるので、大きなイントロンが存在すると5'スプライス部位がCTDから解離する可能性が高まります。CTDから解離した5'スプライス部位が、同じ遺伝子を転写中の別のRNAポリメレースIIのCTDに結合することにより、トランス-スプライシングが起こると考えられます。5'スプライス部位と3'スプライス部位に独立に結合したスプライソソームのサブユニットが会合して反応が進むというスプライシングの反応機構を考えれば、空間的に近傍に位置する任意の組み合わせで5'スプライス部位と3'スプライス部位間でスプライシングが進行することはありえることです。この研究成果は、転写とスプライシングが共役していることの重要性を明確にし、真核細胞が不適切なスプライシングを防ぐためにCTDの機能を介したシステムを構築してきた可能性を示唆しました(Takahara et al., Mol. Cell 18, 245-251, 2005)。
公表論文
- 高原照直、柳澤修一 (2005) 生体内反応としてのトランス-スプラシング. 生化学 77: 1501-1505.
- Takahara T, Tasic B, Maniatis T, Akanuma H, Yanagisawa S. (2005) A delay in the synthesis of the 3´ splice site promotes trans-splicing of the preceding 5´ splice site. Mol. Cell 18: 245-251. [Abstract]
- Takahara T, Kasahara D, Mori D, Yanagisawa S. Akanuma, H. (2002) The trans-spliced variants of Sp1 mRNA in rat. Biochem. Biophys. Res. Commun. 298: 156-262. [Abstract]
- Takahara T, Kanazu S, Yanagisawa S, Akanuma H. (2000) Heterogeneous Sp1 mRNAs in human HepG2 cells include a product of homotypic trans-splicing. J. Biol. Chem. 275: 38067-38072. [Abstract][Full Text][PDF (277 KB)]